Antineoplastik İlaçlar: Klinik Etkinlik, Güvenlik ve Türkiye ile ABD’de Topluma Maliyet Analizi
Prof. Dr. Cankat Tulunay
www.klinikfarmakoloji.com
Özet
Antineoplastik ilaçların hızlandırılmış onay mekanizmaları, onkoloji pratiğinde umut vadeden seçenekler sunarken, bir kısmı doğrulayıcı çalışmalarda klinik fayda göstermemektedir. Prescrire International 2024–2025 güncellemelerinde altı ajan 'Not Acceptable' kategorisine alınmıştır: mifamurtide, nintedanib + docetaxel, panobinostat, trabectedin, vandetanib ve vinflunine. Bu makalede söz konusu ilaçların etkinlik, toksisite ve düzenleyici kurum değerlendirmeleri incelenmekte, ayrıca Türkiye ve ABD’de topluma maliyetleri hesaplanmaktadır. Bulgular, bu ilaçların terapötik ilerleme sunmadığını, ancak çok yüksek maliyet yarattığını göstermektedir.
Giriş
Kanser tedavisinde hızlandırılmış onay mekanizmaları, özellikle yüksek mortaliteli tümörlerde yeni ilaçlara erken erişim imkânı sağlar. Bununla birlikte, bu ilaçların bir kısmı doğrulayıcı faz-3 çalışmalarda genel sağkalım (OS) veya yaşam kalitesi (QoL) avantajı gösteremez. Prescrire, yıllık 'Drugs to Avoid' raporlarında risk-fayda dengesi olumsuz ilaçları 'Not Acceptable' kategorisine ayırır. 2024–2025 raporlarında altı antineoplastik bu kategoriye dahil edilmiştir. Bu ilaçların klinik fayda eksiklikleri yanında yüksek maliyetleri de sağlık sistemleri için yük oluşturmaktadır.
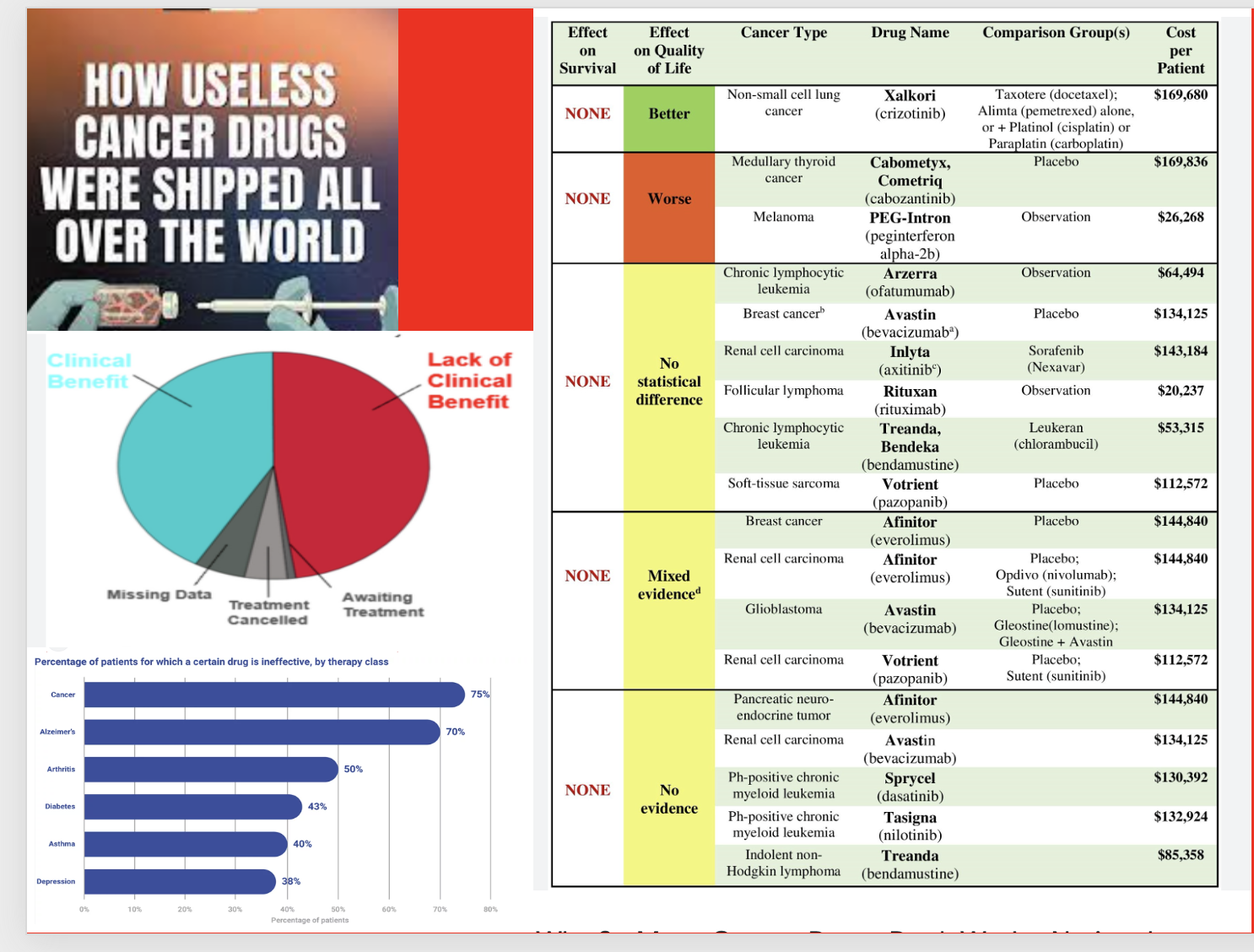
Journal Prescrire’ın araştırmasına göre, 2001-2011 yılları arasında geliştirilen 984 ilacın yanlız 17 tanesi gerçek bir gelişmedir. Benzer şekilde 2010 yılında değerlendirilen 97 ilaçtan yanlız dört tanesi terapötik avantaj sağlamıştır. Ondokuz tanesi faydadan çok zarar veren olarak değerlendirilmiştir.Yeni etkili ilaç keşfedemeyen firmalar eski ilaçlardan sabit doz kombinasyonlar yaparak ve fiyatları astronomik hale getirerek yeni kazanç yolu bulmuş ve soyguna devam demiştir (https://www.klinikfarmakoloji.com/index.php/aci-ilac/buyuk-ilac-firmalari-big-pharma-ilac-firmalarinin-klinik-arastirmalarina-guvenilir-minasil).
Her keşfedilen kanser ilacı hakikaten etkilimidir? Geçen 10-20 yılda keşfedilen birçok kanser ilacının klinik olarak faydalı olabilme olasılığının çok düşük olduğu gözlemlenmiştir. Örneğin, 2008-2012 yılları arasında FDA tarafından onaylanan 54 kanser ilacının ancak üçte biri yaşam süresini uzattığı faz III döneminde gösterilirken ilaç piyasaya çıktıktan sonra ancak 5 tanesinin yaşam süresini anlamlı olarak uzattığı gösterilmiştir. FDA tarafından 2002-2014 yılları arasında solid tümörler için onaylanan kanser ilaçlarının yaşam süresini ortalama 2.1 ay kadar uzattığı gösterilmiştir. Bunun yanında yeni ilaçların emniyetleri ve yan etkileri de ciddi olarak ele alınması gereken bir husustur. Niraula ve arkadaşları yaptıkları meta analizde 2000-2010 yılları arasında 38 solid tümör ilacı ile ilgili yapılan randomize klinik araştırmaları zarar oranı ve yaşam süresini değerlendirmişlerdir. Yeni ilaçlarda toksik ölümlerde ve tedaviyi bırakmada plaseboya göre anlamlı artış gözlenmiştir. Avusturyada 2013-2015 Yılları arasında ruhsat alan 53 kanser ilacı incelendiğinde ancak %32 si yaşam süresini 3 aydan fazla uzatmış, %30 u yaşam süresini değiştirmemiş, diğerleri de 3 aydan daha az yaşam süresini etkilemiştir. C Davis ve arkadaşları Avrupa ilaç Ajansı (EMA) tarafından 2009-2013 yıları arasında onay verilen 48 kanser ilacının 68 endikasyonun 5.4-8.1 sene takiplerinde yaşam süresini uzatmaları ve yaşam kalitesine etkileri yönünden incelediler. EMA tarafından kabul edilen 68 endikasyon için yapılan klinik çalışmaların %12 si kontrolsüz çalışmalardır. 24 Endikasyonda (%35) yaşam süresi 1.0-5.8 ay uzamıştır. Yaşam kalitesi ise 68 endikasyonun ancak %10 nunda iyileşme göstermiştir. Bu ilaçların bildirilen kanser endikasyonlarında yaşam süresi ve kalitesini iyileştirici etkisi ciddi bulgulardan yoksun olmaları yanında bildirilen yaşam süresini uzatıcı etkileri tedavide kullanılan diğer ilaçlara veya plaseboya göre de farklı değildir (https://www.klinikfarmakoloji.com/index.php/aci-ilac/kanser-ilaclari-hastalarin-omrunu-hakikaten-uzatiyor-mu)
Prescrire International’a göre 2013–2022 arasında 99 yeni endikasyon “not acceptable” → bunların 29’u antineoplastik. (Örnekler: Regorafenib (Stivarga) bazı endikasyonlarda → çok küçük PFS yararı, ciddi toksisite. Panobinostat (Farydak) multipl miyelom → çok sınırlı fayda, ciddi yan etkiler., Trabectedin (Yondelis) yumuşak doku sarkomunda → fayda minimal, yan etki belirgin, Pralatrexate (Folotyn) periferal T-hücreli lenfoma → sınırlı veri, yüksek toksisite).
Me-too / “sınırlı ilerleme” kabul edilenler: Birçok ikinci/üçüncü nesil TKI (tirozin kinaz inhibitörleri) veya immünoterapiler yeni endikasyonlarla pazara giriyor → fakat klinik fayda mevcut ilaçlara göre çoğu zaman marjinal (Örn: Bazı yeni PD-1/PD-L1 inhibitörleri, küçük hasta alt gruplarında mevcut immünoterapilere kıyasla anlamlı fark göstermiyor)
Yöntem
Bu derleme, Prescrire International 2024 ve 2025 raporları, EMA ve FDA EPAR belgeleri ile faz-3 randomize kontrollü çalışmalar temel alınarak hazırlanmıştır. Bir antineoplastik ilacın “terapötik ilerleme” sağlamadığı şu kriterlerle belirlenir:
- Klinik fayda eksikliği: Mevcut standart tedavilere kıyasla yaşam süresi (overall survival, OS) veya yaşam kalitesinde anlamlı artış göstermemesi.
- Sadece surrogate endpoint faydası: Yalnızca tümör yanıtı veya progression-free survival (PFS) gibi ara uç noktalarda küçük etkiler, ancak OS’de fayda yok.
- Yan etki profili ağır: Ciddi toksisite, hastaların yaşam kalitesini düşürüyor.
- Maliyet-fayda dengesi zayıf: Çok yüksek fiyat ama sınırlı/şüpheli yarar.
- Onay sonrası başarısızlık: Hızlandırılmış onay alıp doğrulayıcı (phase-3) çalışmalarda başarısızlık (geri çekilme)
Topluma Maliyet Analizi (Türkiye ve ABD):
Perspektif: Türkiyede ödeme kurumu (SGK/TR) ve ABD’de brüt ilaç ödemesi, 1 yıllık süre göz önüne alınmıştır.
Ölçüt: İlaç doğrudan maliyeti ± rejim gerektirdiği kadar yardımcı ilaç. Yan etki yönetimi ve dolaylı maliyetler metinde tartışıldı ancak temel hesapta ayrı kalemlenmedi.
Doz varsayımları (EORTC/ürün bilgisi ile uyumlu tipik kullanım):
- Vandetanib: 300 mg/gün, 365 gün.
- Panobinostat: 20 mg, 3 hafta döngüler.
- Trabectedin: 1.5 mg/m² q3w; BSA 1.8 m² → doz 2.7 mg/siklus (~3 flakon/siklus, 1 mg/flakon).
- Nintedanib (Ofev®): 150 mg BID (60 kapsül/ay).
- Docetaxel: 75 mg/m² q3w → ~135 mg/siklus (BSA 1.8).
- Mifamurtide (Mepact®): 36 haftada 48 infüzyon.
- Vinflunine: TR/ABD erişimi sınırlı.
Formül: Toplam İlaç Maliyeti (yıl) = Σ (Birim Fiyat × Yıllık Birim Kullanım)
Toplumsal Yük = Toplam İlaç Maliyeti (yıl/hasta) × Tedavi Edilen Hasta Sayısı (ilaç fiyatları liste fiyatları üzerinden hesaplanmış, iskonto vs dikkate alınmamıştır)
Bulgular:
1. Klinik etkinlik ve güvenlik:
Mifamurtide: OS faydası yok, ciddi hipersensitivite ve nörolojik toksisite riski.
Nintedanib + Docetaxel: Genel popülasyonda OS farkı yok; ciddi tromboz, kanama, hipertansiyon.
Panobinostat: OS faydası yok, yüksek hematolojik ve GİS toksisite.
Trabectedin: OS avantajı göstermedi; yaygın toksisite.
Vandetanib: OS faydası yok; QTc uzaması, torsades de pointes riski.
Vinflunine: En iyi ihtimalle ortalama 2.4 ay OS uzaması; ağır toksisiteler.
2. Fiyat ve erişilebilirlik
ABD:
- Trabectedin: 1 mg flakon ≈ $3,536; 3 flakon/siklus.
- Ofev® (nintedanib): 60 kapsül ≈ $13,210; yıllık ≈ $158,529.
- Docetaxel: 160 mg flakon ≈ $215.
- Vandetanib: net WAC erişim kısıtlı.
- Panobinostat: ABD’de pazardan çekildi.
Türkiye:
- Yondelis® 1 mg flakon: 61,526.89 TL; 3 flakon/siklus.
- Ofev® 150 mg: 36,512.32 TL/ay (perakende); kamu ≈ 22,672.65 TL/ay.
- Mifamurtide (Mepact®): 98,345.73 TL/flakon; 48 doz ≈ 4.72 milyon TL.
- Vandetanib: TEB yurt dışı ilaç listesinde.
3. Hasta başına yıllık maliyet
ABD:
- Trabectedin: 6 siklus ≈ $63,648.
- Nintedanib: ≈ $158,529.
- Vandetanib: ~90–140k $ bandı.
Türkiye:
- Trabectedin: 6 siklus ≈ 1,107,486 TL.
- Nintedanib: ≈ 272,072 TL/yıl (kamu).
- Mifamurtide: ≈ 4.72 milyon TL/tam kür.
4. Toplumsal yük
Türkiye (3 ilaç):
- Trabectedin: 150 hasta → 166 milyon TL.
- Nintedanib: 500 hasta → 136 milyon TL.
- Mifamurtide: 25 hasta → 118 milyon TL.
Toplam ≈ 420 milyon TL/yıl.
ABD (2 ilaç):
- Trabectedin: 1,000 hasta → $63.6 milyon.
- Nintedanib: 2,000 hasta → $317 milyon.
Toplam ≈ $380 milyon/yıl.
Tartışma
Bu ilaçlar OS faydası göstermemelerine rağmen yüksek maliyet yaratmaktadır. Türkiye’de birkaç yüz hasta yüz milyonlarca TL, ABD’de ise yüz milyonlarca dolar toplumsal yük anlamına gelmektedir. Ayrıca fırsat maliyeti yüksektir; etkinliği kanıtlanmış tarama ve tedavilere ayrılabilecek kaynaklar boşa harcanmaktadır.
Etkisiz veya sınırlı etkili ilaçların klinik ve politik Yansımaları:
- Hastalar için risk: Gereksiz toksisite + boş umut.
- Sağlık sistemleri için yük: Yıllık yüzbinlerce dolarlık ilaç maliyeti → minimal fayda.
- Düzenleyici kurumların rolü:
- FDA hızlandırılmış onay: esneklik sağlıyor, ama doğrulayıcı çalışmalarda başarısızlık sık.
- EMA ve Prescrire gibi kurumlar, “terapötik ilerleme yoksa” negatif görüş bildiriyor.
- Etik boyut: “İnovasyon” adı altında etkisiz / pahalı ilaçların pazarlanması.
Sonuç
Mifamurtide, nintedanib + docetaxel, panobinostat, trabectedin, vandetanib ve vinflunine terapötik ilerleme sunmamaktadır. Buna karşın Türkiye ve ABD’de yıllık yüz milyonlarca liralık/dolarlık maliyet oluşturmaktadır. Bu ilaçların kullanımı yeniden değerlendirilmelidir; geri ödeme otoriteleri fayda-temelli fiyatlandırma ve sıkı denetim politikalarını uygulamalıdır.
Her kanser ilacı mutlak faydalı değildir. Özellikle hızlandırılmış onaylı ilaçlar dikkatle sorgulanmalıdır. Klinisyenler, yalnızca OS/yaşam kalitesi verileri güçlü ilaçlara öncelik vermelidir. Sağlık bakanlığı ve özellikle SGK “Value-based pricing” (fayda temelli fiyatlandırma) ve daha sıkı geri ödeme politikaları izlemeli. Bazı basin-yayın organlarının, ilaç firmalarının lobi faaliyetleri sonucu yaptırdıkları baskıya bilimsel kanıtlarla cevap vermelidir. Dünyanın hiç bir ülkesinde tüm ilaçların geri ödeme listelerinde olmadığı unutulmamalı ve Türkiyenin şartlarına ve hastalık durumuna göre akılcvı ilaç politikaları ve farmakoekonomik analizlele karar vermelidir.
Kaynaklar
1. Prescrire International. Drugs to avoid in 2024: a review of drugs to avoid. Prescrire Int. 2024;33(247):51-62.
2. Prescrire International. Drugs to avoid in 2025 update. Prescrire Int. 2025;34(253):49-59.
3. EMA. Mifamurtide (Mepact) EPAR. 2009.
4. NICE. Mifamurtide for osteosarcoma (TA235). 2011.
5. Reck M, et al. Nintedanib plus docetaxel in NSCLC (LUME-Lung 1). Lancet Oncol. 2014;15(2):143-155.
6. San-Miguel JF, et al. Panobinostat with bortezomib and dexamethasone. Lancet Oncol. 2014;15(11):1195-1206.
7. Demetri GD, et al. Trabectedin vs dacarbazine (T-SAR). J Clin Oncol. 2016;34(8):786-793.
8. Pautier P, et al. Doxorubicin + trabectedin in sarcomas. Lancet Oncol. 2024;25(4):456-468.
9. Wells SA, et al. Vandetanib in medullary thyroid cancer (ZETA). J Clin Oncol. 2012;30(2):134-141.
10. Bellmunt J, et al. Vinflunine vs best supportive care in urothelial carcinoma. J Clin Oncol. 2009;27(27):4454-4461.
11. F. Cankat Tulunay, https://www.klinikfarmakoloji.com/index.php/aci-ilac/kanser-ilaclari-hastalarin-omrunu-hakikaten-uzatiyor-mu
12.F. Cankat Tulunay, https://www.klinikfarmakoloji.com/index.php/aci-ilac/buyuk-ilac-firmalari-big-pharma-ilac-firmalarinin-klinik-arastirmalarina-guvenilir-minasil).







