FDA beklenmedik birşekilde DONANEMAB ile kararını gözden geçirecek.
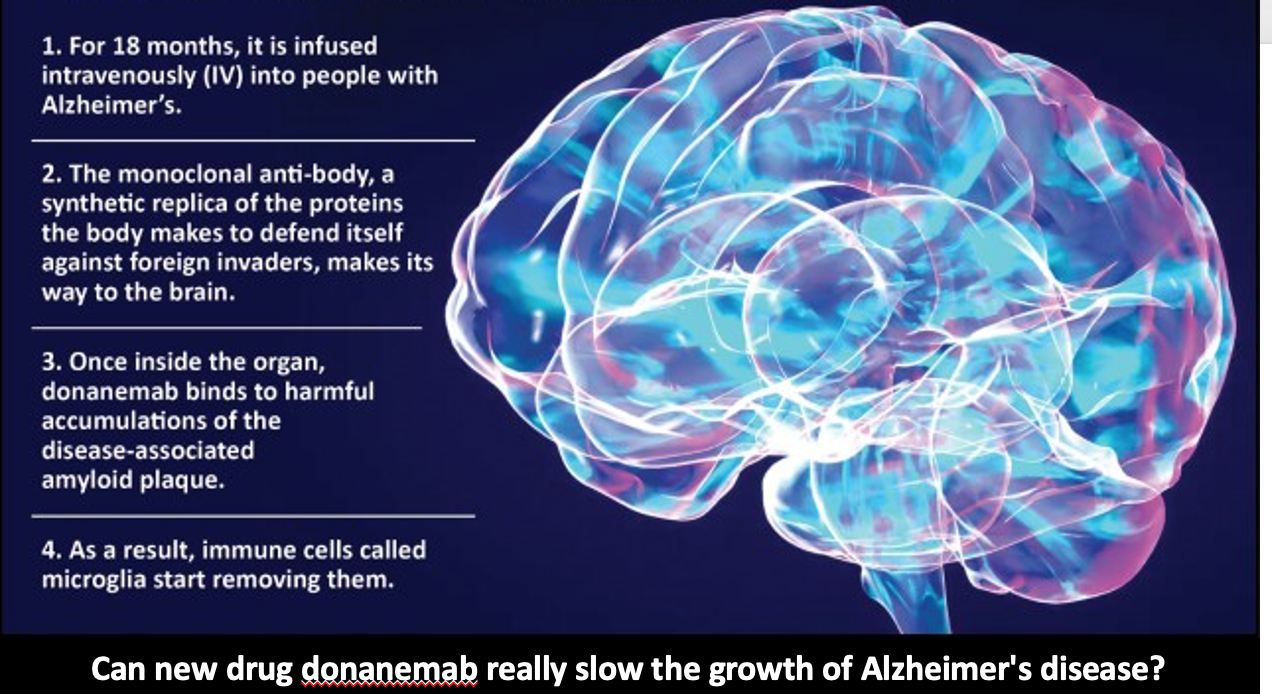
Uzmanlar, donanemab, aducanumab ve lecanemab gibi ilaçların faydalarının potansiyel zararlardan daha fazla olduğunun değerlendirilmesinin zor olduğunu söylüyor. İlaç şirketi Eli Lilly, Mayıs 2023'te, donanemab’ın erken semptomatik Alzheimer hastalığı olan kişilerde bilişsel ve işlevsel düşüşü 18 ayda %35 oranında yavaşlattığını gösterdiğini söyledikleri bir klinik denemeden elde edilen verileri yayınladı. Ancak ABD ilaç kurumunun donanemab'ı onaylamaya hazır olduğuna dair raporlara rağmen, Gıda ve İlaç Dairesi (FDA) bunun yerine 8 Mart'ta kararını ertelediğini açıkladı. FDA, donanemabın güvenliği ve etkinliği hakkındaki verileri daha fazla incelemek için bağımsız bir panel istediğini ve şimdi 2024'te bir kararın beklendiğini söyledi. İngiltere, Avrupa ve Avustralya düzenleyicileri de hala ilacı değerlendiriyor.
El Lilly başkan yardımcısı Anne White:’’ FDA'nın inceleme sürecinin bu aşamasında bir danışma komitesi toplayacağını öğrenmek beklenmedikti, ancak araştırma sonuçlarını daha fazla sunma ve donanemab'ın güçlü etkinliğini güvenlik bağlamına koyma fırsatını dört gözle bekliyoruz" dedi. "
Paris Sorbonne Üniversitesi'nde demans araştırmacısı olan Dr. Timothy Daly, bu gecikmenin kendisi için sürpriz olmadığını söylüyor. Donanemab ve aducanumab ve lecanemab da dahil olmak üzere benzer, çok abartılı ilaçların faydalarının, potansiyel zararlarından daha fazla olduğunu göstermenin zor olduğunun kanıtladığını söylüyor.
Bu ilaçların beyindeki amiloid seviyelerini azalttığı gösterilmiştir. Ancak klinik çalışmalarda lecanemab veya donanemab alan her 10 kişiden üçünde, beyin şişmesine veya kanamaya neden olabilen bir durum olan ARIA olarak kısaltılan, amiloid ile ilişkili görüntüleme anormallikleri olarak bilinen bir durum geliştirdi. Cambridge Üniversitesi'nden Dr. Sebastian Walsh, " Bu yan etki katılımcıların küçük bir yüzdesinde çok daha ciddi görünüyor ve özellikle kan inceltici ilaçlar kullananlar için bazı ölümler oldu. Bazı hastalarda beyin küçülmesi yaşadı ve bunun uzun vadeli etkileri bilinmiyor’’.
Donanemab çalışmasında ilaç alanlar 144 puan üzerinden kognitif ve fonksiyonel skorlarda ortalama 10 puan azalmaya sebep olurken, plasebo kullananlarda bu düşüş 13 puan olmuştur. Araştırmacılar bu verilere dayanarak ilacın plaseboya göre kognitif ve fonksiyonel bozulmayı üçte bir azalttığını ileri sürmüşlerdir. Bazı araştırmacılar ise sonuçların abartıldığını söylemekte. Hollanda Radboud üniversitesinden profesör Edo Richard:’’ her ne kadar ilaç amiloid proteinlerini azaltıyorsa da bu azalma hastalığın iyileştiğini göstermez. Sonuçlar istatistiki olarak anlamlı olsa bile klinik olarak etkisidir’’ diyerek, dikkatli olunmasını önermiştir. Klinik araştırmanın seçilmiş bir grup hastada ve Alzheimerin erken döneminde yapılmış olması, müracaat eden 10 hastadan ikisinin seçilmiş olması da tenkid konusudur. FDA danışma kurulu 2021 de yaptığı değerlendirmede bazı üyeler donenamab’ın etkisinin gösterilemediğini söyleyerek ilaca onay verilmemesini tavsiye etmişlerdir. FDA buna rağmen ilaca onay verince danışma kurulundan üç üye istifa etmiştir (H.arvard Tıp Fakültesinden prof Kesselheim, Washington Üniversitesinden Joel Perlmutter ve Mayo Clinic’ten David Knopman). Pofesör Kesselheim FDA başkanına yazdığı mektupta:’’ Biogen firmasının bu ilacı muhtemelen ABD tarihinde onay alan en kötü ilaçtır’’ demiştir. FDA’in son kararı ile Kesslerheim haklı çıkmış gibi görünmektedir. Donanemab’ın minimal etkili olmasına rağmen ilacın intravenöz kullanımı, 2-4 haftada bir hastaneye yatması gerektiğinden ve bunun senede 26.500-40.500 dolar maliyet getirmesi, ayrıca sık sık bazı tetkiklerin yapılacak olması hasta yakınları ve bakıcıları için düşündürücü olmaktadır.
FDA’in alacağı yeni karar merakla beklenmektedir.
Tenkid edilen araştırma: JAMA, 2023 Aug 8;330(6):512-527, Donanemab in Early Symptomatic Alzheimer Disease: The TRAILBLAZER-ALZ 2 Randomized Clinical Trial







